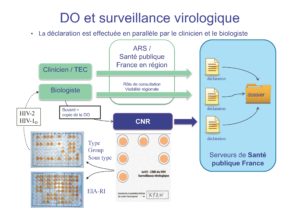
VIH-2
Du fait du pouvoir pathogène plus faible du VIH de type 2 comparé à celui du VIH-1, l’infection à VIH-2 se caractérise par une progression clinique lente, une moindre transmissibilité, un maintien prolongé des lymphocytes CD4 et une détection d’ARN viral plasmatique positive chez seulement environ la moitié des patients et à des titres faibles. En France, environ 2% des patients infectés par le VIH sont porteurs du VIH-2, et environ 0.1% sont co-infectés (VIH-1 et VIH-2). Le pouvoir pathogène plus faible du VIH-2 et sa sensibilité différente aux antirétroviraux justifient de réaliser un typage sérologique spécifique lors de la découverte d’une séropositivité VIH.
Afin de mieux comprendre l’infection à VIH-2, une cohorte nationale prospective multicentrique a été mise en place en France sous l’égide de l’ANRS depuis 1994. Au 31/12/2012, cette cohorte est composée d’environ 900 patients pour lesquels une biothèque (cellulothèque et plasmathèque) est réalisée tous les 6 mois. Des études virologiques et immunologiques satellites y sont menées, permettant de préciser les mécanismes de résistance et les facteurs prédictifs de la progression clinique.
Les tests commercialisés de détermination de la charge virale plasmatique du VIH ne sont pas adaptés au VIH-2. Le laboratoire associé de l’hôpital Bichat-Claude Bernard a développé des tests spécifiques de mesure de la charge virale VIH-2 et peut donc être sollicité pour réaliser cet examen (cf tableau des tests réalisés au CNR du VIH).
Bibliographie
| Généralités, Épidémiologie | Diagnostic | Traitement |
|---|
- Barin F et coll. Prevalence of HIV-2 and HIV-1 group O infections among new HIV diagnoses in France : 2003-2006. AIDS 2007, 21 : 2351-2353.
- Burgard M et coll. Mother-to-child transmission of HIV-2 infection from 1986 to 2007 in the ANRS French périnatal cohort EPF-CO1. Clin Infect Dis 2010, 51 : 833-843.
- Drylewicz J et coll. Comparison of viro-immunological marker changes between HIV-1 and HIV-2-infected patients. AIDS 2008, 22 : 457-468.
- Matheron S et coll. Factors associated with clinical progression in HIV-2 infected-patients : the French ANRS cohort. AIDS 2003, 17 : 2593-2601.
- Thiebaut R et coll. Long-term nonprogressors and elite controllers in the ANRS CO5 HIV-2 cohort. AIDS 2011, 25 : 865-867.
| - Damond F et coll. An international collaboration to standardize HIV-2 viral load assays : results from the 2009 ACHIEV2E quality control study. J Clin Microbiol 2011, 49(10) : 3491-3497.
- Gueudin M et coll. Differences in proviral DNA load between HIV-1- and HIV-2-infected patients. AIDS 2008, 22 : 211-215.
- Visseaux B et coll. Molecular determinants of HIV-2 R5-X4 tropism in the V3 loop : development of a new genotypic tool. J infect Dis 2012, 205 : 111-120.
- Avettand-Fenoel V et coll. New sensitive one-step real-time duplex PCR method for group A and B HIV-2 RNA load. J Clin Microbiol 2014; 52:3017–3022.
- Bertine et coll. New Highly Sensitive Real-Time PCR Assay for HIV-2 Group A and Group B DNA Quantification. J Clin Microbiol. 2017 Sep;55(9):2850-2857.
| - Benard A et coll. Immunovirological response to triple nucleoside reverse-transcriptase inhibitors and ritonavir-boosted protease inhibitors in treatment-naive HIV-2-infected patients : the ACHIEV2E collaboration study group. Clin Infect Dis 2011, 52(10) : 1257-1266.
- Charpentier C et coll. HIV-2EU : supporting standardized HIV-2 drug resistance interpretation in Europe. Clin Infect Dis 2013, 56(11) : 1654-1658.
- Charpentier C et coll. Transmitted drug resistance in French HIV-2-infected patients. AIDS 2013, 27 : 1671-1674.
- Matheron S et coll. CD4 cell recovery in treated HIV-2-infected adults is lower than expected : results from the French ANRS CO5 HIV-2 cohort. AIDS 2006, 20 : 459-462.
- Charpentier C et coll. Genotypic resistance profiles of HIV-2-treated patients in West Africa. AIDS 2014; 28 :1161–1169
- Charpentier C et coll. HIV-2EU-Supporting Standardized HIV-2 Drug-Resistance Interpretation in Europe: An Update. Clin Infect Dis 2015;61:1346–1347.
- Descamps D et coll. Dolutegravir in HIV-2 infected patients with resistant virus to first-line integrase inhibitors from the French Named Patient Program. Clin Infect Dis 2015;60(10):1521-7.
- Visseaux B et coll. Cenicriviroc, a Novel CCR5 (R5) and CCR2 Antagonist, Shows In Vitro Activity against R5 Tropic HIV-2 Clinical Isolates. PLoS ONE 2015;10:e0134904.
- Visseaux B et coll. Tropism distribution among antiretroviral-naive HIV-2-infected patients. AIDS 2015;29:2209–2212.
|
VIH-1 NON-M : LES GROUPES N, O, P.
Alors que l’émergence de ces variants résulte d’évènements de transmission inter-espèces en Afrique, la circulation de ces virus n’a pas de frontières, puisque chacun d’entre eux a été détecté en France. On estime qu’environ 0.1% des patients infectés par le VIH sont porteurs du VIH-1 groupe O dans notre pays. Les variants de groupes N et P sont encore plus rares. L’ensemble de ces variants possèdent des caractéristiques antigéniques et moléculaires distinctes des virus pandémiques du groupe M, qui peuvent être à l’origine de difficultés diagnostiques, et/ou de difficultés du suivi virologique et de prise en charge thérapeutique. Bien que les tests commerciaux actuels de détermination de la charge virale plasmatique couvrent la majeure partie de la diversité génétique des VIH-1, la vigilance doit être maintenue, en particulier lors de discordances immuno-virologiques, ou lors de résultats incohérents entre le diagnostic sérologique et le suivi virologique (charge virale indétectable chez un patient naïf de traitement, ou échec lors de l’amplification génique des régions cibles des antirétroviraux).
Il n’existe pas de tests commerciaux de typage sérologique de l’infection par les VIH-1 non-M. Des outils spécifiques ont été développés par le CNR du VIH. Les différents laboratoires du CNR peuvent être sollicités pour réaliser cet examen (cf tableau des tests réalisés au CNR du VIH). A signaler que le typage sérologique spécifique est effectué systématiquement par le CNR (laboratoire associé, CHU de Tours) dans le cadre de la surveillance virologique liée à la déclaration obligatoire (DO) de séropositivité VIH, et que l’information d’infection par un variant rare est alors signalée au laboratoire ayant fait la DO.
Il est recommandé d’effectuer le suivi de la charge virale par des trousses commerciales validées par le CNR. Le laboratoire associé du CHU de Rouen a développé des tests spécifiques de mesure de la charge virale VIH-1 du groupe O et peut donc être sollicité pour réaliser cet examen (cf tableau des tests réalisés au CNR du VIH). Il est également indispensable d’effectuer un séquençage de résistance par des outils spécifiques.
Bibliographie
| Généralités, Epidémiologie | Diagnostic | Traitement |
|---|
- Barin et coll. Prevalence of HIV-2 and HIV-1 group O infections among new HIV diagnoses in France: 2003-2006. AIDS 2007, 21: 2351-2353.
- Plantier JC et coll. A new human immunodeficiency virus derived from gorillas. Nat Med. 2009 Aug;15(8):871-2.
- Vessière et coll. First evidence of a HIV-1 M/O recombinant form circulating outside Cameroon. AIDS 2010 Apr 24;24(7):1079-82.
- Delaugerre C et coll. HIV-1 group N: travelling beyond Cameroon. Lancet. 2011 Nov 26;378(9806):1894.
- Mourez T et coll. Non-M variants of human immunodeficiency virus type 1. Clin Microbiol Rev. 2013 Jul;26(3):448-61
- Unal G et coll. First report of transmission of a highly resistant strain of HIV-1 group O. AIDS. 2016 Oct 23;30(16):2565-2568.
| - Gautheret-Dejean et al. Unequal detection of HIV type 1 group O infection by simple rapid tests. Clin Infect Dis. 2008 Jun 15;46(12):1936-7.
- Depatureaux A et al. Specific diagnosis and follow-up of HIV-1 group O infection: RES-O data. Med Mal Infect. 2010 Dec;40(12):669-76.
- Plantier JC et coll. Census and analysis of persistent false-negative results in serological diagnosis of human immunodeficiency virus type 1 group O infections. J Clin Microbiol. 2009 Sep;47(9):2906-11.
- Gueudin M et coll. A new real-time quantitative PCR for diagnosis and monitoring of HIV-1 group O infection. J Clin Microbiol. 2012 Mar;50(3):831-6.
- Laperche S et coll. Failures in the detection of HIV p24 antigen with the Determine HIV-1/2 Ag/Ab Combo rapid test. J Infect Dis. 2012 Dec 15;206(12):1946-7.
- Ly TD et coll. The variable sensitivity of HIV Ag/Ab combination assays in the detection of p24Ag according to genotype could compromise the diagnosis of early HIV infection. J Clin Virol. 2012 Oct;55(2):121-7.
- Lemee V et coll. Performance of the Liaison XL Murex HIV Ab/Ag test on clinical samples representing current epidemic HIV variants. J Clin Microbiol. 2014 Sep;52(9):3277-9.
- Sire JM et coll. Comparative RNA quantification of HIV-1 group M and non-M with the Roche Cobas AmpliPrep/Cobas TaqMan HIV-1 v2.0 and Abbott Real-Time HIV-1 PCR assays. J Acquir Immune Defic Syndr. 2011 Mar 1;56(3):239-43.
- Mourez T et coll. Comparison of the bioMérieux NucliSENS EasyQ HIV-1 v2.0-HIV-1 RNA quantification assay versus Abbott RealTime HIV-1 and Roche Cobas TaqMan HIV-1 v2.0 on current epidemic HIV-1 variants. J Clin Virol. 2015 Oct;71:76-81.
- Gueudin M et coll. Performance Evaluation of the New HIV-1 Quantification Assay, Xpert HIV-1 Viral Load, on a Wide Panel of HIV-1 Variants. J Acquir Immune Defic Syndr. 2016 Aug 15;72(5):521-6.
| - Depatureaux A et coll. Baseline genotypic and phenotypic susceptibilities of HIV-1 group O to enfuvirtide. Antimicrob Agents Chemother. 2010 Sep;54(9):4016-9.
- Depatureaux A et coll. Impact of HIV-1 group O genetic diversity on genotypic resistance interpretation by algorithms designed for HIV-1 group M. J Acquir Immune Defic Syndr. 2011 Feb 1;56(2):139-45.
- Depatureaux A et coll. Raltegravir-based regimens are effective in HIV-1 group O-infected patients. J Acquir Immune Defic Syndr. 2012 Sep 1;61(1):e1-3.
- Alessandri-Gradt E et coll. HIV-1 group O resistance pathway with raltegravir is similar to HIV-1 group M. AIDS. 2015 Jun 19;29(10):1271-3.
- Alessandri-Gradt E et coll. HIV-1 non-group M phenotypic susceptibility to integrase strand transfer inhibitors. J Antimicrob Chemother. 2017 Sep 1;72(9):2431-2437.
|