La radiothérapie est une méthode de traitement locorégionale des cancers. Sont but est de délivrer une dose capable de détruire la tumeur et les éventuels ganglions adjacents en veillant à ce que les tissus non envahis à proximité de la tumeur reçoivent la dose la moins élevée possible. La tumeur visible et ses extensions microscopiques (cellules dispersées dans les tissus avoisinants) sont appelées « volume cible » et les tissus non envahis proches de la tumeur « organes à risques » du fait de la possible altération de leur fonction s’ils reçoivent une dose au-delà de leur seuil de tolérance. On parle alors de complications.
Jusqu’aux années 70, les appareils de radiothérapie ne permettaient de traiter que des tumeurs superficielles délimitables cliniquement, ou des tumeurs plus profondes situées dans des cavités (vagin, utérus..) grâce à l’insertion de sources de radium (Curiethérapie).
Le développement des accélérateurs linéaires de particules permettant de générer des photons de basses et hautes énergies a fait entrer la radiothérapie dans son ère moderne puisque toutes les tumeurs quelques soient leurs profondeurs et localisations sont devenues accessibles et localisables par rapport à l’anatomie osseuse, grâce à des appareils de radiographies appelés « simulateurs » (technique 2D).
Les avancées technologiques des accélérateurs, l’adaptation des équipements radiologiques 3D à la radiothérapie et le développement de logiciels de calcul de la dose de plus en plus puissants ont permis à la radiothérapie d’être en constante évolution pour améliorer le service médical rendu au patient : précision, qualité, sécurité, confort.
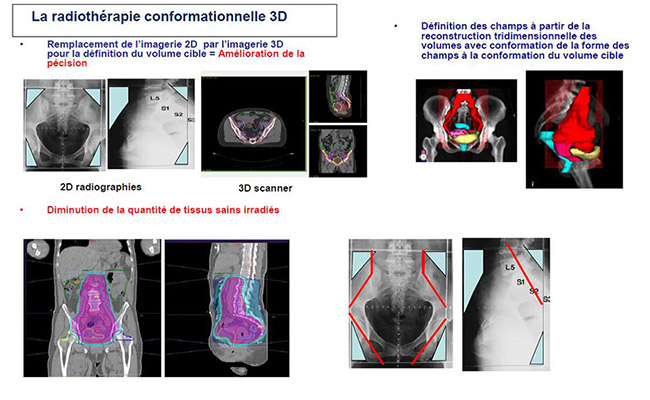
Les années 90 ont été marquées par le développement de la radiothérapie de conformation, appelée radiothérapie 3D. Grâce à des logiciels spécifiques, le volume cible et les organes à risques ont pu être dessinés sur des images scannographiques et la forme des champs d’irradiation a pu être adaptée à la forme du volume cible, d’où le terme radiothérapie de conformation.
Les protections en alliage ont été remplacées par des systèmes de paires de lames intégrés dans la tête des accélérateurs (collimateurs multilames) pour générer des formes complexes. Cette technique conformationnelle est maintenant considérée comme la technique de base à appliquer dans les cas les plus simples. En comparaison avec la technique 2D, elle a permis de réduire considérablement le volume de tissus sains inclus dans les champs d’irradiation. Cependant, du fait d’un certain nombre d’incertitudes de positionnement de la tumeur au cours des séances de traitement, une partie de tissus sains au contact de la tumeur reste incluse dans les champs d’irradiation et reçoit une dose pratiquement identique à celle de la tumeur.
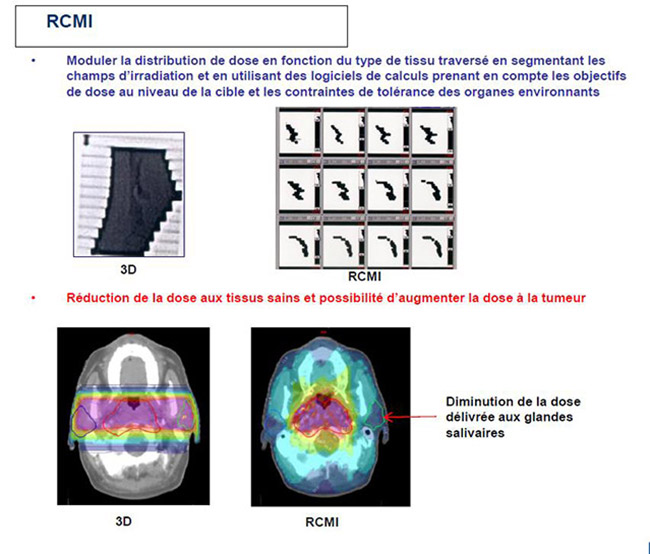
La radiothérapie conformationnelle avec modulation d’intensité (RCMI) a été l’une des grandes innovations des années 2000. La RCMI, comme son nom l’indique, a pour but de délivrer aux différents types de tissus inclus dans le champ d’irradiation une intensité d’irradiation différente, donc une dose plus ou moins élevée en fonction que le tissu soit tumoral ou non tumoral.
Ceci est rendu possible grâce à une segmentation des champs d’irradiation et grâce à des logiciels de calcul capables de prendre en compte des contraintes de dose différentes dans chacun des segments. La délivrance de cette irradiation est facilitée par concomitance du mouvement des lames du collimateur et du mouvement du bras de l’appareil de traitement.
La RCMI permet de diminuer la dose aux organes sains situés au contact de la tumeur (et donc de diminuer le risque de complications) tout en permettant, si cela le nécessite, d’augmenter la dose au volume cible et potentiellement l’efficacité du traitement.
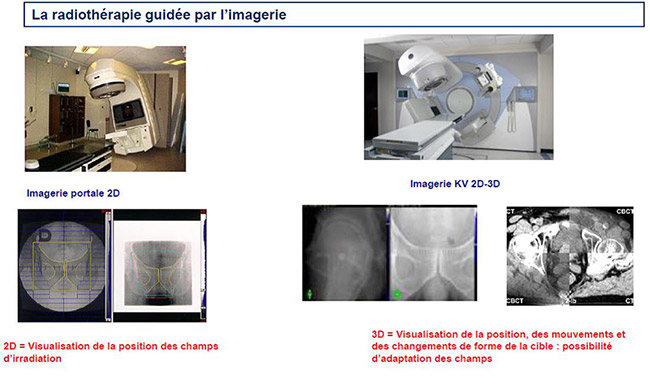
La vérification de la précision de l’installation du patient et des champs d’irradiation est indissociable de la mise en œuvre d’une radiothérapie quelle que soit la technique. Dans les années 70 on utilisait des images radiographiques appelées « gammagraphie » Qui permettait de visualiser le positionnement du champ d’irradiation par rapport à des repères osseux.
L’installation des accélérateurs de particules permettant de délivrer la radiothérapie conformationnelle a permis de mettre en œuvre des systèmes d’imagerie numérisée 2D appelés « imagerie portale ». La RCMI nécessite de vérifier non seulement la position du patient, mais également de visualiser la position du volume cible, ses mouvements et ces éventuels changements de forme au cours du temps.
Les avancées technologiques ont permis de coupler des systèmes d’imagerie aux accélérateurs pour obtenir des images de type scanner localisées sur la zone à traiter (CBCT). On peut ainsi parler véritablement de radiothérapie guidée par l’imagerie, car des adaptations sont possibles à chaque séance de traitement.
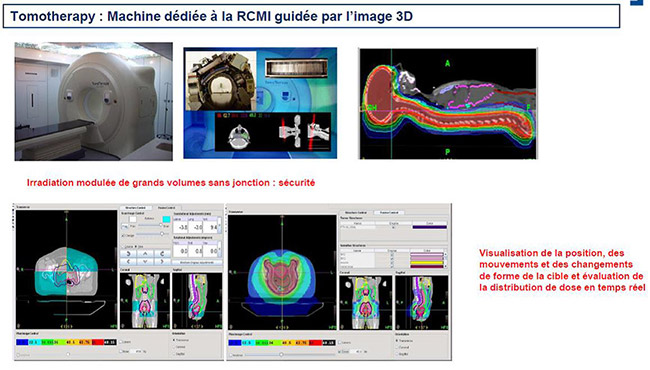
La Tomothérapie, une machine dédiée à la RCMI en mode dynamique hélicoïdal, permet de traiter différentes zones de quelques centimètres de longueur jusqu’à 1m60 sans interruption et en un seul passage. Elle se distingue des autres appareils qui dispensent la RCMI parce qu’elle associe dans une même machine un accélérateur de particules et un système d’imagerie tomographique hélicoïdal.
Le système TomoTherapy permet de délivrer des doses via de multiples rotations de l’accélérateur à 360° ou, via seulement certains angles, pendant que la table se déplace (de quelques centimètres à plus d’un mètre) en continu pour balayer la zone traitée.
En fonction de la topographie de la tumeur et de la complexité de sa présentation, la modulation de la dose peut se faire sur des segments variant de 1 à 5 cm. C’est pourquoi, la Tomotherapy est l’accélérateur le plus adapté, non seulement pour les tumeurs de la moelle épinière de l’enfant et de l’adulte, pour les irradiations lymphoïdes et médullaires totales ou les sarcomes étendus, mais également pour des indications complexes comme les tumeurs ORL et de la thyroïde, mais aussi des tumeurs pelviennes, urogénitales, des tumeurs du médiastin supérieur, des tumeurs de la paroi thoracique. Le système de guidage par imagerie 3D permet aux médecins de vérifier la précision du positionnement du patient et de sa tumeur, comme sur les autres machines non dédiées.
Le couplage à la projection de la distribution de dose sur le scanner de positionnement (fonctionnalité disponible uniquement sur la Tomotherapy) permet de délivrer des doses précises et personnalisées à chaque type de tumeur selon sa forme, sa profondeur et de les adapter en fonction des changements de forme de la zone à traiter.
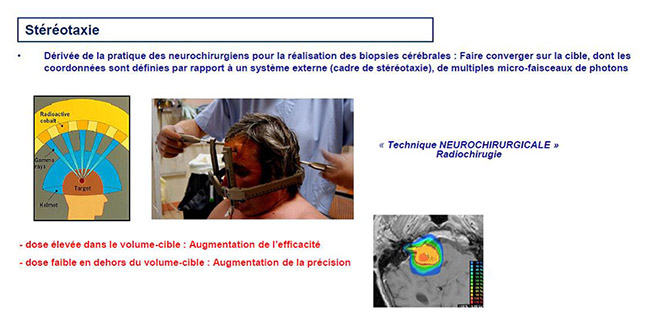
L’irradiation stéréotaxique est une méthode de traitement dérivée de la méthode mise au point dans les années 60 par Leksell, neurochirurgien de Stockholm, pour traiter des tumeurs cérébrales inaccessibles chirurgicalement. Il s’agit d’une technique dont l’objectif est la détermination des coordonnées spatiales de la lésion par rapport à un référentiel appelé cadre de stéréotaxie.
Initialement, il s’agissait d’un cadre fait de tiges métalliques graduées qui devait être fixé sur la voûte crânienne du patient à l’aide de vis. Cette technique imposait que le traitement soit réalisé le plus souvent en une seule fraction, c’est pourquoi la technique a été d’abord décrite sous le « terme de radio-chirurgie ». Le principe est de faire converger plusieurs micro-faisceaux sur la cible dont les coordonnées sont connues en temps réel dans les 3 plans de l’espace grâce au cadre, qui est à la fois un moyen de contention et un moyen de repérage. Il est alors possible de réaliser une irradiation extrêmement sélective (précision millimétrique) à dose élevée qui épargne presque totalement les tissus sains autour de la tumeur.
La transposition de cette technique d’irradiation aux volumes extra-crâniens comme les tumeurs pulmonaires inopérables, les métastases hépatiques, ganglionnaires, a été possible lorsqu’un système limitant les mouvements internes dus à la respiration a été mis à disposition par les constructeurs.
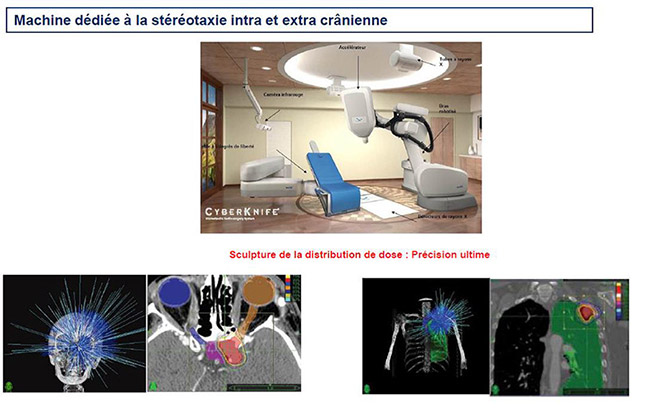
Le Système CyberKnife associe une technologie de guidage par imagerie continue à un accélérateur linéaire compact capable de se déplacer dans l’espace selon un plan de traitement défini en amont de l’intervention.
Ce système dit de « robotique intelligente » est dédié au traitement de tumeurs extra- et intracrâniennes en dirigeant de façon très précise les rayonnements de très haute intensité directement vers la tumeur tout en suivant les possibles mouvements de celle-ci en temps réel sans avoir recours à des repères externes. Ce sont des repères anatomiques internes (os, opacités pulmonaires ou marqueurs implantés) qui vont être suivis en temps réel par l’imagerie répétée toutes les X secondes.
La précision du traitement est encore accrue par rapport à la stéréotaxie délivrée par des machines non dédiées et le confort du patient est amélioré du fait de l’absence de moyen de contention contraignant.
Le service de radiothérapie du CHRU de Tours a mis en œuvre au cours du temps toutes les évolutions des techniques de radiothérapie. La radiothérapie conformationnelle est devenue un standard de traitement dès la fin des années 90, la RCMI à la fin des années 2000. Depuis 2015, le plateau technique de radiothérapie dispose d’une Tomotherapy.
Les patients porteurs de lésions relevant d’une indication d’irradiation stéréotaxique intra-crânienne ont pu en bénéficier en routine à partir de 2004 et les patients relevant d’une indication d’irradiation stéréotaxique extra-crânienne à partir de 2010. Ces irradiations stéréotaxiques sont toutes réalisées actuellement avec le Cyberknife. Cette marche vers l’innovation s’est accompagnée d’une gestion rigoureuse de la qualité et des risques qui a été particulièrement remarquée lors de la visite de certification de la Haute Autorité de Santé (HAS) en avril 2015.
L’amélioration du service médical rendu au patient reste une priorité au sein du CHRU, mais également dans la perspective de projets régionaux ou interrégionaux notamment dans le domaine de la protonthérapie.
La radiothérapie métabolique consiste à utiliser des médicaments radiopharmaceutiques émetteurs de particules β- ou α qui vont entrer dans la cellule cancéreuse ou se fixer à elles à la faveur de son métabolisme ou de ses récepteurs. Lors de la désintégration nucléaire grâce à leurs propriétés physiques, ces particules vont transmettre une grande quantité d’énergie sur un trajet très court permettant ainsi d’irradier et de détruire sélectivement les cellules cancéreuses visées.
Parmi ces traitements, le plus connus est le traitement par I131 utilisé dans le cadre du cancer de la thyroïde de souche folliculaire effectuée lors d’une hospitalisation de 72h à la CORAD. D’autres traitements effectués en ambulatoire peuvent être cité :
- Les traitements antalgiques de certaines métastases osseuses notamment dans le cancer de la prostate (par Samarium153, Strontium89 ou Radium223).
- Les traitements par anticorps marqués dans le cadre de certains lymphomes résistant à la chimiothérapie (marquage à l’Yttrium90).
Le produit est injecté par voie veineuse et va se fixer sur les cellules tumorales. Quand le produit a une durée de vie longue, le malade est isolé à cause des risques d’irradiation de l’entourage et de l’environnement. Ces traitements sont réalisés dans le service de médecine nucléaire du CHRU à l’hôpital Bretonneau.
