Les activités du centre :
La Fécondation In Vitro (FIV) a pour but de reproduire au laboratoire les premières étapes de la fécondation qui se déroulent normalement dans les trompes.
Pour cela, elle réalise en dehors de l’organisme (donc in vitro), la rencontre de l’ovocyte et du spermatozoïde, la fécondation puis les premiers jours du développement embryonnaire.
A l’issue de la tentative de la Fécondation In Vitro, un embryon sera transféré dans la cavité utérine.
La Fécondation In Vitro existe dans le monde depuis 1978. Elle est encadrée en France par les lois de Bioéthique (1994, 2004, 2011, 2021) imposant le respect de certaines règles.
Notre centre fonctionne depuis 1984 et nous réalisons chaque année entre 600 et 800 tentatives de la Fécondation In Vitro.
LES INDICATIONS MÉDICALES
La technique de fécondation in vitro est proposée plus ou moins tôt dans le parcours du projet parental du couple :
- Dans certains cas, la fécondation in vitro intervient après un suivi thérapeutique préalable (induction de l’ovulation, inséminations intra-utérines, traitement chirurgical gynécologique) n’ayant pas permis d’obtenir de grossesse évolutive.
- Dans d’autres cas, l’indication de fécondation in vitro peut être portée d’emblée si les autres traitements évoqués ci-dessus ne sont pas adaptés pour résoudre le problème médical.
Aucune des deux situations n’est plus favorable ou défavorable pour l’obtention d’une grossesse en fécondation in vitro ; il s’agit seulement d’indications différentes.
Deux techniques de Fécondation In Vitro sont disponibles pour permettre la fécondation des gamètes.
Elles diffèrent par leur antériorité, leur méthodologie et leurs indications. Ce sont :
- La Fécondation In Vitro classique
– Première naissance mondiale en 1978 (Angleterre).
– Première naissance au CHRU de Tours en 1985. - L’ICSI ou microinjection
– Première naissance mondiale en 1992 (Belgique).
– Première naissance au CHRU de Tours en 1995.
Les principales indications de la fécondation in vitro classique sont :
- L’infertilité tubaire.
- L’altération modérée du sperme.
- L’endométriose sévère.
- Les troubles majeurs de l’ovulation.
- L’échec d’un ou plusieurs cycles d’inséminations intra utérines.
Les principales indications de l’ICSI sont :
- L’altération sévère du sperme.
- Certaines azoospermies (absence totale de spermatozoïde dans l’éjaculat) pour lesquelles il est parfois possible de prélever chirurgicalement les spermatozoïdes au niveau de l’épididyme ou du testicule.
- L’échec inexpliqué de fécondation ou une pauci-fécondation à l’issue d’une tentative de fécondation in vitro (FIV) classique : taux de fécondation trop faible des ovocytes matures.
Dans tous les cas, il est important de se souvenir qu’en dehors d’une impossibilité définitive à concevoir, chaque couple hétérosexuel orienté vers une fécondation in vitro conserve des chances de grossesse naturelle avant ou après une tentative de fécondation in vitro même si l’indication de fécondation in vitro reste tout à fait justifiée.
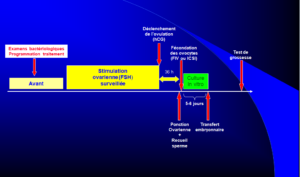
LE DÉROULEMENT D’UNE TENTATIVE DE FÉCONDATION IN VITRO (FIV)
La programmation de la tentative de fécondation in vitro (FIV)
Avant la tentative de fécondation in vitro (FIV), chaque couple/femme non mariée a au moins deux consultations avec un médecin, rencontre la psychologue du service et assiste à une réunion d’information (programmation un vendredi par mois de 18h00 à 20h00).
Le mois prévu pour la réalisation de la tentative est précisé par le médecin qui vous suit. La tentative intervient en moyenne cinq à six mois après votre premier rendez-vous mais la programmation varie selon l’importance des examens complémentaires à réaliser et leur délai de mise en œuvre.
Le mois précédent la tentative des examens bactériologiques sont réalisés. Ils s’assurent de l’absence de germes dans le sperme et les urines de l’homme et au niveau du vagin et du col de l’utérus de la femme.
Ces examens permettent de réduire au maximum le risque de contamination des milieux de culture lors de la mise en fécondation au laboratoire et le risque de contamination de l’embryon lors du transfert intra utérin.
Lors de cette consultation, sont remis les ordonnances du traitement de stimulation ovarienne et le planning des examens de surveillance. Enfin la période probable pour la ponction folliculaire est établie.
Le délai entre deux tentatives de FEV est de 4 à 6 mois.
La stimulation ovarienne et sa surveillance
La stimulation ovarienne permet le développement de plusieurs follicules lors du cycle de stimulation et en conséquence, le recueil ultérieur de plusieurs ovocytes et l’obtention de plusieurs embryons.
Une sélection du ou des 2 meilleurs embryons pour le transfert intra utérin est alors possible ce qui optimise les chances de succès.
Le nombre de follicules recrutés lors d’un cycle de fécondation in vitro (FIV) est le plus souvent compris entre 6 et 20 follicules de plus de 12 mm.
Lorsque le nombre de follicules recruté est très faible (moins de 5 follicules), les chances de succès s’amenuisent considérablement. Cela peut amener à annuler le cycle de traitement voire à reconsidérer l’opportunité d’une tentative de fécondation in vitro (FIV).
Lorsque le nombre de follicule recrutés est très important (plus de 20 follicules), il existe un risque accru d’hyperstimulation ovarienne. Cela nécessite un ajustement du traitement et une surveillance accrue voire un arrêt de traitement.
Il paraît donc essentiel d’adapter le protocole de stimulation en fonction du profil de réponse individuelle de chaque patiente, afin d’augmenter les chances de grossesse et limiter les risques médicaux. C’est à cette occasion que les examens complémentaires demandés lors du bilan prennent toute leur importance.
Plusieurs protocoles de stimulation existent. Ils utilisent tous des injections sous-cutanées qui peuvent être soit réalisées par une infirmière ou par la patiente elle-même.
L’horaire d’injection est le plus souvent entre 18H00 et 20H00 (exceptionnellement une injection supplémentaire est ajoutée le matin entre 7H00 et 9H00).
La durée du protocole de stimulation est variable allant de 2 à 4 semaines.
Quelques effets secondaires sont possibles (maux de tête, vertiges, bouffées de chaleur, troubles du sommeil) en début de protocole mais ils restent en général modérés et n’empêchent pas les activités journalières habituelles.
Au cours de la stimulation, la montée du taux sanguin d’oestradiol peut occasionner une tension mammaire. Si des nausées ainsi qu’une gêne abdominale croissante apparaissent au fur et à mesure de la stimulation, il faut le signaler à l’équipe médicale car il peut s’agir d’un début d’hyperstimulation ovarienne qu’il convient de maîtriser.
La période de stimulation se termine lorsqu’un nombre suffisant de follicules matures est recruté. Une injection est programmée pour déclencher l’ovulation. Cette dernière injection est faite entre 21H00 et minuit.
Il est nécessaire de réaliser des examens de surveillance du traitement de stimulation pour adapter les doses afin de donner les meilleures chances de succès et d’éviter une hyperstimulation ovarienne.
La surveillance est le plus souvent faite au CHRU au sein même du service. Un arrêt de travail pourra vous être délivré pour la durée du suivi. Il est quelquefois possible de réaliser le début de surveillance près du domicile si vous habitez loin ou si vous voulez continuer à travailler. Cela sera discuté avec le médecin en consultation.
Pendant la surveillance, une prise de sang et une échographie sont réalisées de façon régulière (tous les jours ou tous les deux jours) par une sage-femme qui pourra répondre à vos questions . Si cela est nécessaire, l’avis d’un médecin sera demandé. Vous pouvez aussi, si vous en ressentez le besoin, rencontrer la psychologue pendant le suivi de fécondation in vitro (FIV).
La période de surveillance dure en moyenne une semaine.
La ponction ovarienne
La ponction folliculaire a lieu le surlendemain de la piqûre de déclenchement de l’ovulation.
La présence des deux membres du couple est obligatoire dans tous les cas.
Il faut se présenter à 7H00 dans le secteur d’hospitalisation.
Madame doit être à jeun (c’est-à-dire ni manger, ni boire, ni fumer) depuis la veille au soir minuit.
Une analgésie par prémédication médicamenteuse (voie orale et intra musculaire) est assurée dans 75 à 80% des ponctions
Une anesthésie générale (AG ou Rachianesthésie) est programmée dans 20 à 25% des ponctions. Cette dernière est décidée par le médecin en fonction de la situation clinique (accessibilité des ovaires, nombre de follicules).
Le choix de la procédure d’anesthésie est de la compétence de l’anesthésiste.
salle de ponction
La ponction s’effectue par voie transvaginale sous contrôle échographique le matin. Elle dure en moyenne 10 minutes. Le nombre d’ovocytes recueillis vous est communiqué tout de suite après la ponction.
Une collation légère est donnée vers 13h00 et la sortie est programmée entre 15h30 et 16h30.
La patiente doit obligatoirement être accompagnée lors de la sortie.
Les ovules de progestérone par voie vaginale sont à commencer le soir même.
Ponction endovaginale échoguidée avec pompe
Image échographique de follicules (flèche) en croissance au niveau ovarien
Dans le liquide issu de la ponction des follicules ovariens, les ovocytes sont immédiatement recherchés par le laboratoire de fécondation in vitro (FIV) voisin de la salle de ponction.
Les ovocytes sont alors conservés dans un milieu de culture nécessaire à leur survie et placés dans un incubateur avant leur mise en fécondation.
Loupe dans une hotte de recueil des ovocytes
Ovocytes dans le liquide folliculaire
Le recueil de sperme et sa préparation
Le recueil de sperme est le plus souvent nécessaire le même jour que la ponction ovarienne (sauf cas particuliers).
Le recueil se déroule selon le même principe qu’un examen de sperme (spermogramme), à savoir :
- Respecter un délai d’abstinence sexuelle de 2 à 7 jours
- Recueil de sperme par masturbation
- Respecter des règles d’hygiène pour le recueil
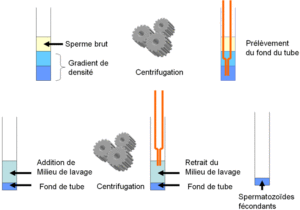
Principe général de la préparation de sperme
- L’objectif principal est de concentrer dans un petit volume les spermatozoïdes les plus fécondants, c’est-à-dire mobiles et de morphologie normale.
- Cette préparation se réalise dans le laboratoire à partir du sperme brut par centrifugations successives et avec l’aide d’un gradient de densité
Préparation du sperme par gradient de densité
La mise en fécondation
Fécondation in vitro (FIV) classique
Les spermatozoïdes issus de la préparation sont déposés au voisinage des ovocytes dans une boîte contenant du milieu de culture nécessaire à la survie des ovocytes et des spermatozoïdes.
Ovocyte au recueil
Spermatozoïdes
Boîte de culture
ICSI ou microinjection
Cette technique nécessite aussi une préparation des ovocytes (appelée décoronisation) en plus de la préparation des spermatozoïdes.
Cette préparation des ovocytes permet de visualiser dès le jour de la ponction, la qualité des ovocytes recueillis en terme de maturité nucléaire.
L’ICSI consiste en une injection directe d’un spermatozoïde vivant dans chaque ovocyte mature.
Cette microinjection nécessite évidemment un appareillage microscopique particulier
Ovocyte mature
Ovocyte immatures
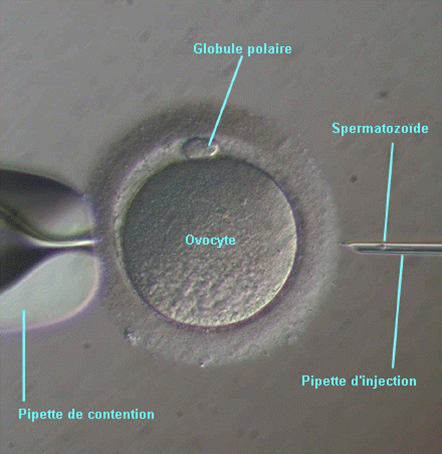
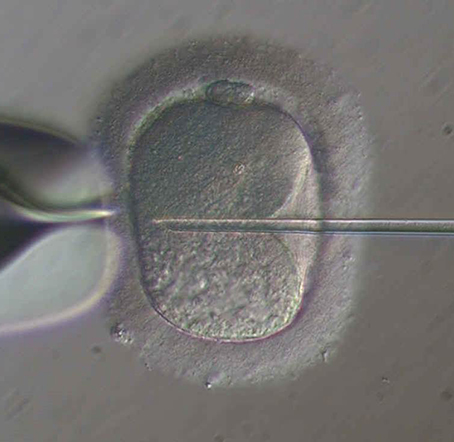
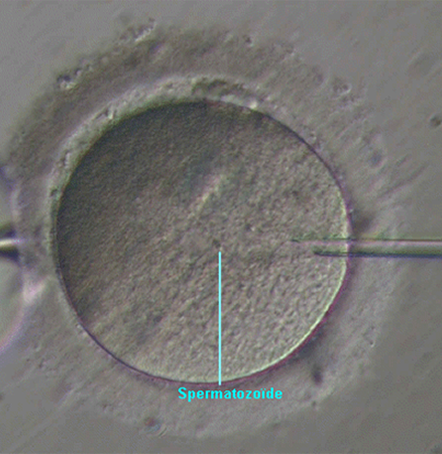
Geste de microinjection d’un spermatozoïde (ICSI)
Le développement embryonnaire in vitro
Toutes les étapes qui suivent sont communes que la fécondation ait eu lieu par fécondation in vitro (FIV) classique ou par ICSI.
Le lendemain de la mise en fécondation (J1), une première observation permet de vérifier le déroulement normal du processus de fécondation.
Absence de Fécondation
Fécondation normale
Le surlendemain de la mise en fécondation (J2), une nouvelle observation permet de vérifier le déroulement initial du développement embryonnaire.
Le laboratoire de fécondation in vitro (FIV) observe individuellement les embryons pour déterminer le devenir de chacun d’eux :
- La mise en culture prolongée jusqu’au stade blastocyste
- L’élimination à J2 (embryon non viable)
Embryon fragmenté (non viable)
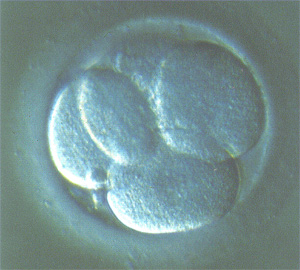
Embryon à 4 cellules
Une mise en culture prolongée des embryons jusqu’au stade blastocyste (J5/J6) est réalisée pour tous les embryons de la cohorte en vue d’un transfert et/ou d’une congélation au stade blastocyste.
Dans ce cas, la culture embryonnaire prolongée est réalisée jusqu’au 5ème ou 6ème jour après la ponction (J5/J6).
Blastocyste en cours d’éclosion
Le transfert embryonnaire
Le transfert embryonnaire s’effectue 5 ou 6 jours après la ponction (stade blastocyste).
Le transfert est réalisé en fin de matinée.
Le blastocyste à transférer est placé dans une goutte de milieu puis monté à l’extrémité d’un cathéter de transfert.
Le geste du transfert est simple, rapide et indolore.
Le médecin dépose le blastocyste à l’intérieur de la cavité utérine en passant par le col de l’utérus.
Le transfert embryonnaire
Après le transfert embryonnaire, il faut vivre normalement en évitant les efforts violents.
Un arrêt de travail n’est nécessaire que si la situation clinique le justifie.
Le premier dosage sanguin de bhCG détermine s’il y a une grossesse débutante.
Il est à faire dans un laboratoire d’analyses médicales près du domicile environ 7 jours après le transfert.
La date est précisée sur l’ordonnance et il n’est pas nécessaire d’être à jeun pour la prise de sang.
Si le premier dosage est supérieur à 10 UI/l, le dosage peut être considéré comme positif. Il doit être confirmé par deux autres dosages effectués 48H00 après le premier puis 7 jours après.
Si le taux du 3ème dosage atteint 1000 UI/l, la progression est considérée comme satisfaisante et une échographie est programmée 5 à 6 semaines après le transfert du ou des embryons pour confirmer l’évolutivité et la localisation de la grossesse.
Cette échographie peut être effectuée chez votre gynécologue ou dans un cabinet de radiologie ou d’échographies.
Si la grossesse est évolutive, les complications sont équivalentes à celles rencontrées dans une grossesse démarrée naturellement. La surveillance obstétricale est la même.
Si le premier dosage est compris entre 5 UI et 10 UI/l, le dosage est faiblement positif.
Pour s’assurer qu’il s’agit bien d’un début de grossesse il faut réaliser un deuxième dosage 48H00 plus tard. Le nouveau dosage doit alors avoir doublé.
Si le premier dosage est inférieur à 5 UI/l,le dosage est considéré comme négatif.
La grossesse n’a pas débuté.
Les règles surviennent dans la semaine et il faut arrêter les ovules de progestérone.
Si les règles n’arrivent pas dans la semaine ou semblent anormales il est prudent de refaire un deuxième dosage.
Les principales complications
La complication principale de la fécondation in vitro (FIV) est le syndrome d’hyperstimulation ovarienne.
Il survient le plus souvent après le transfert embryonnaire et plus fréquemment en cas de démarrage de grossesse. Il peut s’amorcer quelquefois avant le transfert ou même pendant la période de stimulation.
Les symptômes ressentis sont plus ou moins importants et douloureux. Ils comprennent un gonflement abdominal avec douleurs pelviennes, des troubles digestifs comprenant nausées, vomissements ou diarrhée, une gêne respiratoire.
Il faut alors prévenir l’équipe médicale. Un examen clinique, un bilan sanguin et une échographie apprécieront la gravité de l’hyperstimulation et orienteront vers la prise en charge thérapeutique la plus appropriée. Celle-ci peut aller du repos à domicile avec prise d’antalgiques à l’hospitalisation.
Le plus important est bien sûr LA PREVENTION, en adaptant au mieux le traitement de stimulation.
Les complications de la ponction folliculaire sont rares et le plus souvent bénignes.
Les complications sont plus fréquentes si les ovaires sont difficilement accessibles.
Il s’agit le plus souvent de saignements.
- Un saignement au point de ponction se résout facilement après compression.
- Un saignement intra-pelvien peut exceptionnellement nécessiter un geste chirurgical sous coelioscopie.
La congélation embryonnaire
Certains embryons surnuméraires peuvent être congelés au stade blastocyste.
Ils doivent répondre à une certaine exigence en terme d’aspect morphologique pour résister au mieux aux contraintes physiques des étapes de congélation/décongélation : c’est pourquoi la congélation embryonnaire concerne seulement 40 à 50% des couples réalisant une fécondation in vitro (FIV).
Cette congélation est réalisée uniquement si vous avez donné votre accord pour le faire (consentement).
Quand une congélation embryonnaire est possible, cela signifie pour le couple une chance supplémentaire de succès pour la tentative de fécondation in vitro (FIV) qui vient de se dérouler car le transfert d’embryons congelés n’est pas comptabilisé comme une nouvelle tentative mais fait partie de la tentative initiale.
Depuis janvier 2014, les blastocystes sont systématiquement congelés par vitrification dans notre centre. Cette technique a permis d’améliorer significativement le taux de survie des blastocystes congélés et le taux de naissance des enfants nés grâce à cette technique.
Un transfert d’embryon congelé sera programmé avant toute nouvelle stimulation ovarienne.
La présence du conjoint est obligatoire pour le transfert d’embryon(s) congelé(s).
Cuve de stockage d’embryons